北京大学分子医学研究所梁子才研究室揭示小核酸激活基因作用机制
本世纪初人们发现双链小RNA能诱导同源mRNA的高效特异性降解导致基因抑制(或沉默)(RNAi),从而确立了核酸干扰现象作为一个基因表达调控的重要机制的地位,并促成了小核酸制药作为一个生物制药新兴战略领域的出现。近年来研究发现双链小RNA还可以通过靶向启动子区而激活目的基因的表达,这一双链小RNA的新功能被称为RNA激活(RNAa)。RNAa现象的发现表明双链小RNA对基因表达的调控具有“阴(RNAi)/阳(RNAa)”双向性。这种“激活型”小核酸有望成为一类重要的新型基因调控分子和药物因而开始备受关注。
从作用机制研究方面,与RNAi机制在多年研究后基本获得解析的情况相反,目前国际上对RNAa的发生机制尚不清楚。近日,由北大分子医学研究所梁子才组完成的题为“Small activating RNA binds to the genomic target site in a seed-region-dependent manner”的研究论文提供了重要实验证据揭示了小核酸激活基因的机制,该论文已经于2月11日在线发表于Nucleic Acids Research(《核酸研究》或NAR)杂志。
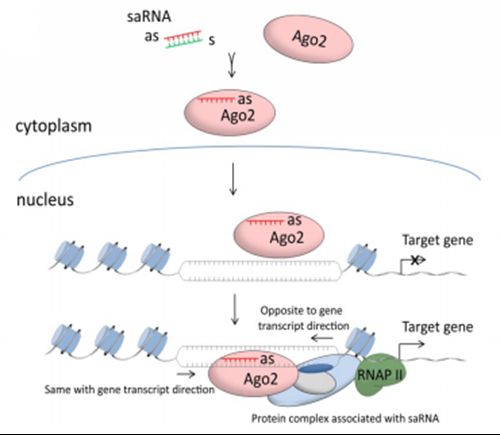
该研究基于已有的小RNA技术平台,以黄体酮受体作为基因激活模型发现小激活RNA (saRNA)双链中的反义链(antisense strand,as)而非正义链(sense strand,s)能与Ago2蛋白有效结合从而引发基因激活过程,进一步发现反义链的5’端序列很关键,具有类似microRNA种子序列(seed-region)的作用特点。更重要的是,该研究质疑了现有的“启动子区反义转录本(antisense transcript)介导RNA激活”的观点,利用CRISPR/Cas9靶向DNA位点敲除技术,证明RNA激活现象是在saRNA同源启动子“on site”现场发生的过程,即saRNA反义链通过5’端种子区与启动子DNA直接结合,与基因的反义转录本无关。
十年来,梁子才教授课题组在小核酸技术与相关领域深入耕耘,成果累累,在该领域国际著名和知名杂志已发表文章70多篇。这项发表在NAR(《核酸研究》)的工作在解析saRNA的作用机制方面取得了重要进展,为RNA激活的应用提供了重要实验依据。本文第一作者是北京大学分子医学研究所博士生孟醒同学,梁子才教授和曹慧青副研究员为通讯作者。该研究受到国家自然科学基金、863计划的经费支持。值得一提的是,RNAa的发现者,中国医学科学院北京协和医院的海归学者李龙承教授关于RNAa机制的研究文章,近期也在Cell Research发表。该文与本文互为补充和印证,构成近期在RNAa领域的主要进展。
编辑:山石
下一篇::分子医学研究所李川昀课题组发布猴群体遗传学平台RhesusBase PopGateway